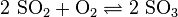A hidrogén-peroxid halványkék színű folyadék, híg oldatban színtelen. Gyenge sav, erős oxidálószer.
Tartalomjegyzék[elrejtés] |
Fizikai tulajdonságai [szerkesztés]
Színtelen, sűrű, szagtalan, keserű, nem éghető folyadék, gőze irritálja a szemet és az orrot. Sűrűsége a víznél másfélszer nagyobb (1456 kg/m3). −1°C-on színtelen kristályokká fagy, forráspontja (116 °C) azonban közvetlenül nem határozható meg, mert magasabb hőmérsékleten bomlékony. Vízzel minden arányban elegyedik.
Molekulaszerkezet [szerkesztés]
A hidrogén-peroxid molekulája a vízhez hasonlóan erősen poláros, molekulái között hidrogénkötések alakulnak ki, ez okozza aránylag magas olvadás- és forráspontját. Molekulájában a két O-atom közvetlenül, peroxokötéssel kapcsolódik egymáshoz, másik párosítatlan elektronjuk pedig egy-egy hidrogénatommal alkot kötést. A peroxokötés elég gyenge, kötési energiája nem nagy, ezért a hidrogén-peroxid erősen bomlékony. Bomlásakor hőfejlődés közben víz és oxigén keletkezik:
- 2 H2O2 = 2 H2O + O2
Kémiai tulajdonságai [szerkesztés]
Vizes oldatai is bomlékonyak, és 30%-osnál nagyobb töménység esetében robbanásveszélyesek. A tiszta, alacsony hőmérsékletű hidrogén-peroxid bomlása aránylag lassú. A reakciósebességet nagyfelületű szilárd anyagok, különösen nehézfémek és sóik növelik, vagyis katalizátorként viselkednek. Még az üvegfelület is gyengén katalizálólag hat rá, ezért tiszta, tömény oldatát polietilén, vagy paraffinnal bevont üvegedényben tárolják.
-O-O- csoportot tartalmazó vegyület. Általában különböző koncentrációjú vizes oldatban kerül kereskedelmi forgalomba. Erélyes oxidálószer, esetenként redukálószer. Könnyen bomlik, hőfejlődés kíséretében. Ruhán vagy más éghető szerves anyagon megszáradva tüzet okozhat. Hő, napfény és szerves anyagok hatására bomlik. A teljesen tiszta, szennyeződésmentes oldat stabil, elektromosan semleges.
Reakciók [szerkesztés]
Bomlás:
- 2 H2O2 = 2 H2O + O2
Oxidálószer: a halogenideket halogénné oxidálja:
- 2 I− + H2O2 + 2 H+ = I2 + 2 H2O
→jodidokból jódot tesz szabaddá
Redukálószerként is viselkedhet: Kálium-permanganátból oxigént fejleszt:
- 2 MnO4− + 5 H2O2 + 6 H+ = 2 Mn2+ + 8 H2O + 5 O2
→így is lehet laboratóriumban oxigént fejleszteni
szulfidokat szulfáttá oxidálja
- PbS + 4 H2O2 = PbSO4 + 4 H2O
→a fekete ólom-szulfidot fehér ólom-szulfáttá oxidálja
Erős oxidáló hatása miatt fertőtlenítőszer és színtelenítőszer; használják például hajszőkítésre. Mivel oxidáció során csak "környezetbarát" termékek keletkeznek, a modern vegyiparban egyre elterjedtebben használják más, környezetvédelmi szempontból károsabb oxidálószerek kiváltására.
Előállítás [szerkesztés]
Eredetileg bárium-peroxid híg kénsavval való reakciója során állították elő:
- BaO2 + H2SO4 = BaSO4 + H2O2
Korábban az iparban közepesen tömény kénsav elektrolízisével gyártották
- H2SO4 = H+ + HSO−4
a katódon redukálódó hidrogén-szulfát-ionok (HSO−4 → HSO4• + e−) egymással peroxo-dikénsavvá egyesülnek:
- 2 HSO4• → H2S2O8
A peroxo-dikénsav vizes oldata pedig 80-100 °C-on kénsavra és hidrogén-peroxidra hidrolizál:
- H2S2O8 + 2 H2O = 2 H2SO4 + H2O2
Az így gyártott hidrogén-peroxid azonban rendkívül drága volt, mely általános elterjedését gátolta.
Napjainkban szinte kizárólag antrahidrokinon oxigénnel való reakciójával állítják elő (antrahidrokinon-oldatba levegőt buborékokltatva). Ekkor első lépésben oxigén addícionál az antrahidrokinonra, és ez a labilis köztes termék híg sav hatására hidrogén-peroxid és antrakinon képződése közben bomlik. A hidrogén-peroxidot extrakcióval elválasztják, desztillációval tisztítják és töményítik, az antrakinont pedig hidrogénnel, katalizátor jelenlétében visszaalakítják a kiindulási antrahidrokinonná. Az antrakinon tehát folyamatosan újra felhasználásra kerül, végső soron ezzel az eljárással hidrogénből és oxigénből közvetlenül hidrogén-peroxid nyerhető. A folyamatban a hidrogén-peroxid és az antrakinon elválasztását oldószeres extrakcióval végzik, ezért nem a vízben viszonylag jól oldódó antrahidrokinont használják, hanem ennek hidrofób, hosszabb-rövidebb alkil-csoporttal ellátott származékát (leggyakrabban a 2-etil-antrahidrokinont), mely szinte veszteség nélkül elválasztható a hidrogén-peroxidtól.
Ezt a módszert Riedl-Pfleiderer eljárásnak nevezik.[2][3]
1994-ban a világtermelés 1.9 millió tonna volt, ez 2006-ra 2.2 millió tonnára nőtt[4]. Ipari célra leginkább 30-70%-os oldatokat forgalmaznak. 2006-ban a 30%-os oldat nagykereskedlmi ára 0,54 USD/kg volt, Magyarországon 1 m3-es mennyiségben ára 2010-ben 90-100 HUF/kg körül van.
Felhasználás [szerkesztés]
- színtelenítő- és fehérítőszer, számos tisztítószer tartalmazza származékait
- klórmentes fertőtlenítőkben
- laboratóriumban oxidálószerként
- vegyiparban környezetbarát technológiákban oxidálószerként
- szennyvizek ártalmatlanítására
- az orvosi gyakorlatban dezinficiáló- és szagtalanítószerként
- a vízmentes hidrogén-peroxidot lökhajtásos repülőgépek, rakéták üzemanyagaként használják.
Források [szerkesztés]
- ^ a b c A hidrogén-peroxid (ESIS)
- ↑ Jose M. Campos-Martin, Gema Blanco-Brieva, Jose L. G. Fierro (2006.). „Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process”. Angewandte Chemie International Edition 45 (42), p. 6962–6984. DOI:10.1002/anie.200503779.
- ↑ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (October 2, 1936 in USA, and October 10, 1935 in Germany) to I. G. Farbenindustrie, Germany
- ↑ Ronald Hage, Achim Lienke (2005.). „Applications of Transition-Metal Catalysts to Textile and Wood-Pulp Bleaching”. Angewandte Chemie International Edition 45 (2), p. 206–222. DOI:10.1002/anie.200500525.
forrás: http://hu.wikipedia.org/wiki/Hidrog%C3%A9n-peroxid