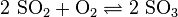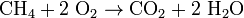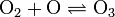Az oxigén (vagy régies nevén éleny) az oxigéncsoport elemei közé tartozik a kénnel, a szelénnel, és a tellúrral együtt. A rendszáma 8, a vegyjele O. Vegyértékelektron-szerkezete 2s22p4. Az oxigén a Föld leggyakoribb eleme, hiszen a földkéreg tömegének majdnem felét oxigén teszi ki (természetesen kötött állapotban), de az oxigén a világegyetem gyakoribb elemei közé is tartozik, hiszen az ötödik leggyakoribb elem. A légkör jelentős része oxigéngáz (O2), de ózon (O3) formában is megtalálható (igaz ez a molekulaszerkezet sokkal instabilabb, az ózon az oxigéngáz allotróp módosulata).
Az oxigént Joseph Priestley angol kémikus fedezte fel 1774-ben, de ő még deflogisztonizált levegőnek nevezte a flogiszton-elmélet nyomán. Később Antoine Laurent de Lavoisier francia kémikus nevezte el oxigénnek. Neve a görög oxigenium (savképző) szóból származik.
Az oxigéngáz színtelen, szagtalan, íztelen, kétatomos molekulákból álló anyag. Folyékony és szilárd halmazállapotban kék színű. Molekularácsban kristályosodik. Molekulája apoláris, benne kettős kötés található. Apoláris tulajdonsága miatt vízben rosszul, bár a nitrogénnél jobban oldódik (100 cm3 víz 20 °C-on 4,14 mg O2-t old). A vízben oldott oxigénnek jelentős élettani hatása van, csakúgy mint a légkörinek. Apoláris oldószerekben jól oldódik, ezért (is) okoz komoly problémát, ha olaj kerül a víz felszínére (az olaj filmréteget képezve elzárja az oxigént a víztől, így az képtelen abban oldódni, továbbá a már oldott oxigén „átvándorol” az olajba, ezzel csökkentve a vízben az oxigén mennyiségét).
Kémiai tulajdonságai [szerkesztés]
Az oxigén szobahőmérsékleten nem túl reakcióképes, ennek oka a kettős kötésben keresendő. Magas hőmérsékleten az elemekkel exoterm reakcióban egyesül (égés). Erős oxidálószer (innen a folyamat neve), különösen az egyatomos oxigén, mely annyira reagens, hogy a természetben csak nagyon rövid ideig létezik (jelölése 'O').
- reakciója fémekkel:
- reakciója nemfémes elemekkel:
- reakciója szervetlen vegyületekkel:
- reakciója szerves vegyületekkel:
- az ózonképződés egyenlete: (megfordítható)
Élettani szerep [szerkesztés]
Az oxigén nélkülözhetetlen az élethez (a biológiai oxidáció folyamatához). Az ózon fertőtlenítő hatású. A légkör felső rétegeiben ózonréteget képezve véd az UV-sugaraktól, a földfelszín közelében lévő ózon azonban mérgező.
Előfordulása, előállítása [szerkesztés]
A földkéreg súlyának fele oxigén, mind kötött, mind szabad állapotban előfordul. A földi élet elengedhetetlen feltétele, az atmoszféra 21% oxigént tartalmaz. Mennyisége a fotoszintézissel növekszik, a biológiai oxidációval csökken. Jelenléte biztosítja a földi életet, jelenléte következtében a légkörünk oxidáló légkör. 99%-ban a folyékony levegő frakcionált desztillációjával és 1%-ban a víz elektrolitikus bontásával állítják elő.
Az ózon a légkör felső rétegeiben keletkezik elektromos szikra és rövidhullámú sugárzás hatására. Az ózon elnyeli a káros ultraibolya (UV) sugarakat, a légkör magasabb rétegeiben ózonréteget alkot, mely napjainkban sajnos némely helyeken meglehetősen elvékonyodott (átlagos vastagsága 8 km).
Leggyakoribb oxigénvegyületek [szerkesztés]
- hidridjei (víz és hidrogén-peroxid)
- szerves vegyületek, pl.: alkoholok, fenolok, karbonsavak, éterek, észterek, aldehidek, ketonok
- szervetlen savak
- különböző oxidok (lásd lentebb)
Felhasználása [szerkesztés]
Nagy részét égőkben a befúvott levegő dúsítására használják és a metanol, valamint az acél gyártásánál is fontos a szerepe. Orvosi célokra is felhasználják. A cseppfolyós oxigén a folyékony hajtóanyagú rakétákban a tüzelőanyag elégetéséhez szükséges. Forgalomba nagynyomású, kék színű acélpalackban hozzák. Rendkívüli elővigyázatosságot igényel a palack használata a nagyfokú robbanásveszély miatt!
Az ózont fertőtlenítésre, fehérítésre, italok érlelésére használják
Naszcensz oxigén [szerkesztés]
Naszcensz. Latin szó, jelentése a születés pillanatában lévő. A kémiában a keletkező, kiválás pillanatában lévő, még atomos állapotú elemekre (gázokra) használják. Az ilyen nascens anyagok az atomos állapotuk miatt, rendkívül reakcióképesek.
Ilyen például a hidrogén-peroxidból felszabaduló oxigén:
Nascens oxigén szabadul fel az ózonból is. Ezért nagyon erős oxidálószer a hidrogén-peroxid és az ózon. Nascens klór keletkezik a királyvízből, ezért lép reakcióba még az arannyal is. Savakból egyes fémek hatására (pl. sósav és cink reakciója során) nascens hidrogén keletkezik, ami viszont rendkívül erős redukálószer.